Alicante, 10 sep (EFE).- Investigadores del Instituto de Neurociencias han identificado dos enzimas que colaboran para evitar que las neuronas activen genes inadecuados, lo que garantiza su correcto funcionamiento, un hallazgo que abre nuevas vías para comprender el origen de trastornos neurológicos asociados a mutaciones en estos genes, como la discapacidad intelectual.

Las neuronas son células altamente especializadas y su correcto funcionamiento depende de que conserven su identidad a lo largo de toda la vida.
El equipo del laboratorio Mecanismos transcripcionales y epigenéticos de la plasticidad neuronal, en el Instituto de Neurociencias, centro mixto de la Universidad Miguel Hernández de Elche (UMH) y del Consejo Superior de Investigaciones Científicas (CSIC), ha identificado que dos enzimas, KDM1A y KDM5C, interactúan para trabajar como auténticas “guardianas epigenéticas”.
Es decir, su función es silenciar los genes que no corresponden a las neuronas y mantener activas únicamente las instrucciones adecuadas, según un comunicado del Instituto de Neurociencias.
Para llevar a cabo este estudio, publicado recientemente en la revista Cell Reports, el equipo dirigido por el investigador Ángel Barco utilizó un modelo de ratón en el que eliminó simultáneamente los genes de KDM1A y KDM5C en neuronas del cerebro adulto.
Esto les permitió estudiar qué ocurre cuando se pierde este control epigenético en neuronas maduras y no solo durante el desarrollo.
“Lo sorprendente es que la acción conjunta de estas dos enzimas va más allá de la suma de sus efectos individuales”, según Barco, quien ha revelado: «Cuando ambas fallan, las neuronas empiezan a expresar genes que no le corresponden, con consecuencias negativas para la memoria, la capacidad de aprendizaje y la regulación de la ansiedad del animal».
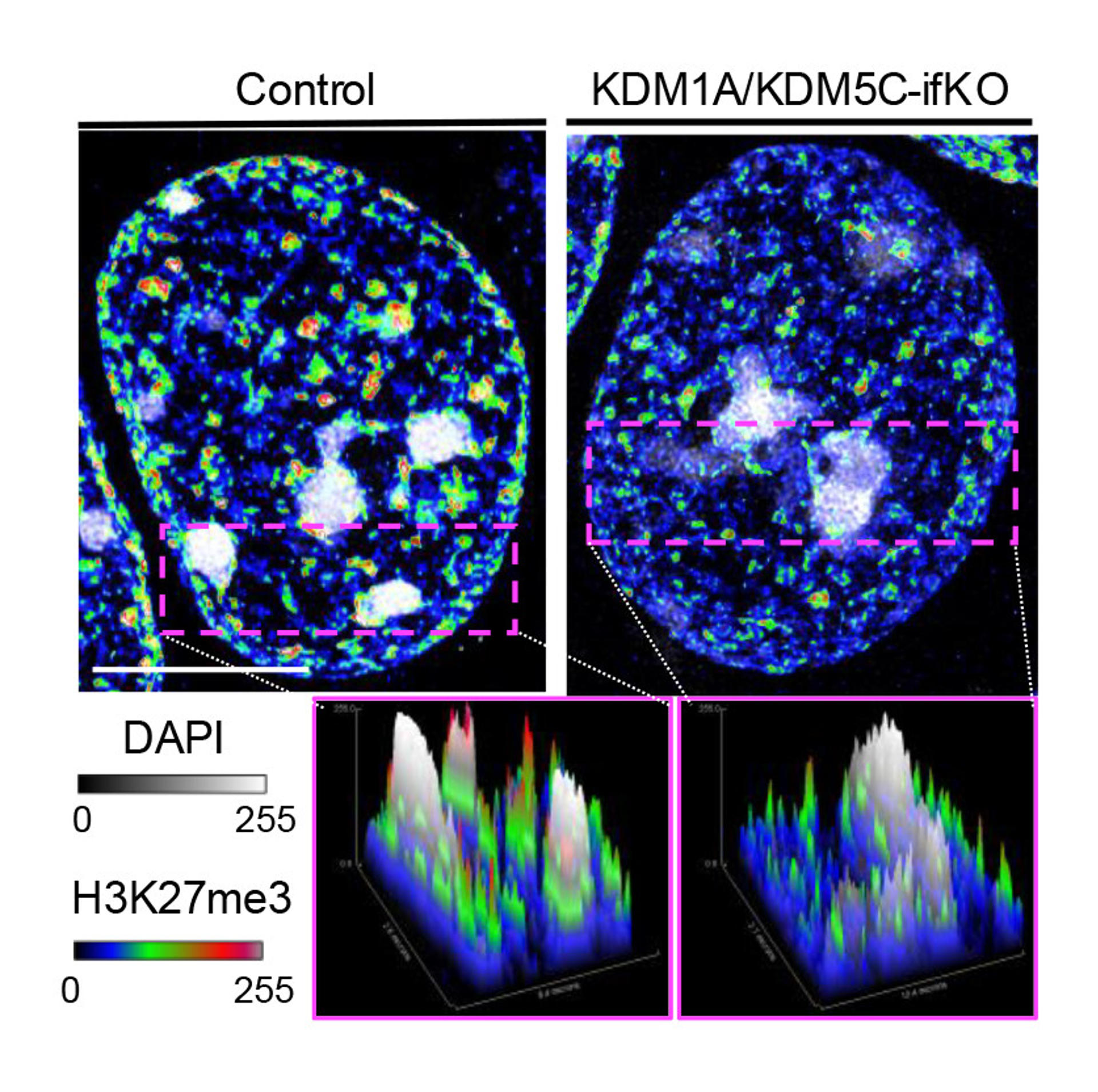
Mediante un enfoque multidisciplinar que combina genética, biología molecular, electrofisiología, microscopía de superresolución, estudios de comportamiento y análisis genómicos a gran escala, los investigadores observaron que la pérdida de ambas enzimas altera profundamente el paisaje epigenético de la neurona: numerosas regiones del genoma acumulaban una marca epigenética (H3K4me3) asociada normalmente a genes activos en zonas que deberían permanecer inactivas.
Además, detectaron una desorganización en la estructura tridimensional del genoma neuronal. Estos cambios se traducen en alteraciones en la fisiología de las neuronas, como una mayor excitabilidad, que repercuten negativamente en el comportamiento y en las capacidades cognitivas de los ratones.
Estos resultados suponen un avance para entender el origen de los trastornos neurológicos asociados a la discapacidad intelectual causados por mutaciones en reguladores epigenéticos.
«Comprender cómo interaccionan estas enzimas no solo nos ayuda a descifrar la biología de las neuronas, sino también a identificar posibles mecanismos implicados en enfermedades neurológicas”, ha destacado el investigador Juan Paraíso Luna, también primer autor del artículo.
Este estudio complementa trabajos previos del mismo laboratorio, ubicado en el campus de Sant Joan d’Alacant de la UMH, que ya habían demostrado la relevancia de cada una de estas enzimas por separado: KDM1A, esencial para preservar la organización tridimensional del genoma y prevenir su deterioro asociado al envejecimiento, y KDM5C, necesaria para evitar transcripciones erróneas y afinar la respuesta de las neuronas a los estímulos.
La novedad ahora es que ambas proteínas cooperan para preservar la identidad neuronal. “Las mutaciones en los genes de KDM1A y KDM5C se han asociado en humanos con discapacidad intelectual y otros trastornos neurológicos, por lo que este trabajo abre una ventana a nuevas investigaciones que nos pueden ayudar a profundizar en el origen de ciertas enfermedades del cerebro”, ha indicado Barco.