Redacción Ciencia, 24 jun (EFE).- Un equipo científico neerlandés ha conseguido editar con éxito mutaciones dañinas en el ADN mitocondrial en células humanas y lo ha hecho usando una herramienta genética conocida como editor de bases. Los expertos creen que este avance supone una nueva esperanza para las personas con enfermedades genéticas raras.
Los detalles de la investigación, liderada por dos científicos del Centro de Medicina Regenerativa de Utrecht (Países Bajos), se ha publicado este martes en la revista Plos Biology.
Hasta ahora, las técnicas de edición genética han permitido introducir y corregir mutaciones del ADN mitocondrial relacionadas con enfermedades en células hepáticas y cutáneas.
Las mitocondrias, a menudo llamadas las centrales energéticas de la célula, tienen su propio pequeño conjunto de ADN y sus mutaciones pueden provocar una amplia gama de enfermedades heredadas por vía materna, cáncer y afecciones relacionadas con el envejecimiento.
Por eso, aunque la tecnología de edición genética CRISPR ha ayudado a los científicos a corregir las mutaciones en el ADN nuclear, este sistema no puede atravesar eficazmente la membrana mitocondrial y llegar al ADN mitocondrial, por lo que muchos pacientes mitocondriales no se han podido beneficiar de los avances de la técnica CRISPR.
Para superar este problema, el equipo empleó una herramienta llamada editor de bases DdCBE (editor de bases de citosina derivado de la toxina A de la desaminasa del ADN de doble cadena), que permite cambiar una sola letra del código del ADN sin cortarlo, y funciona con el ADN mitocondrial.
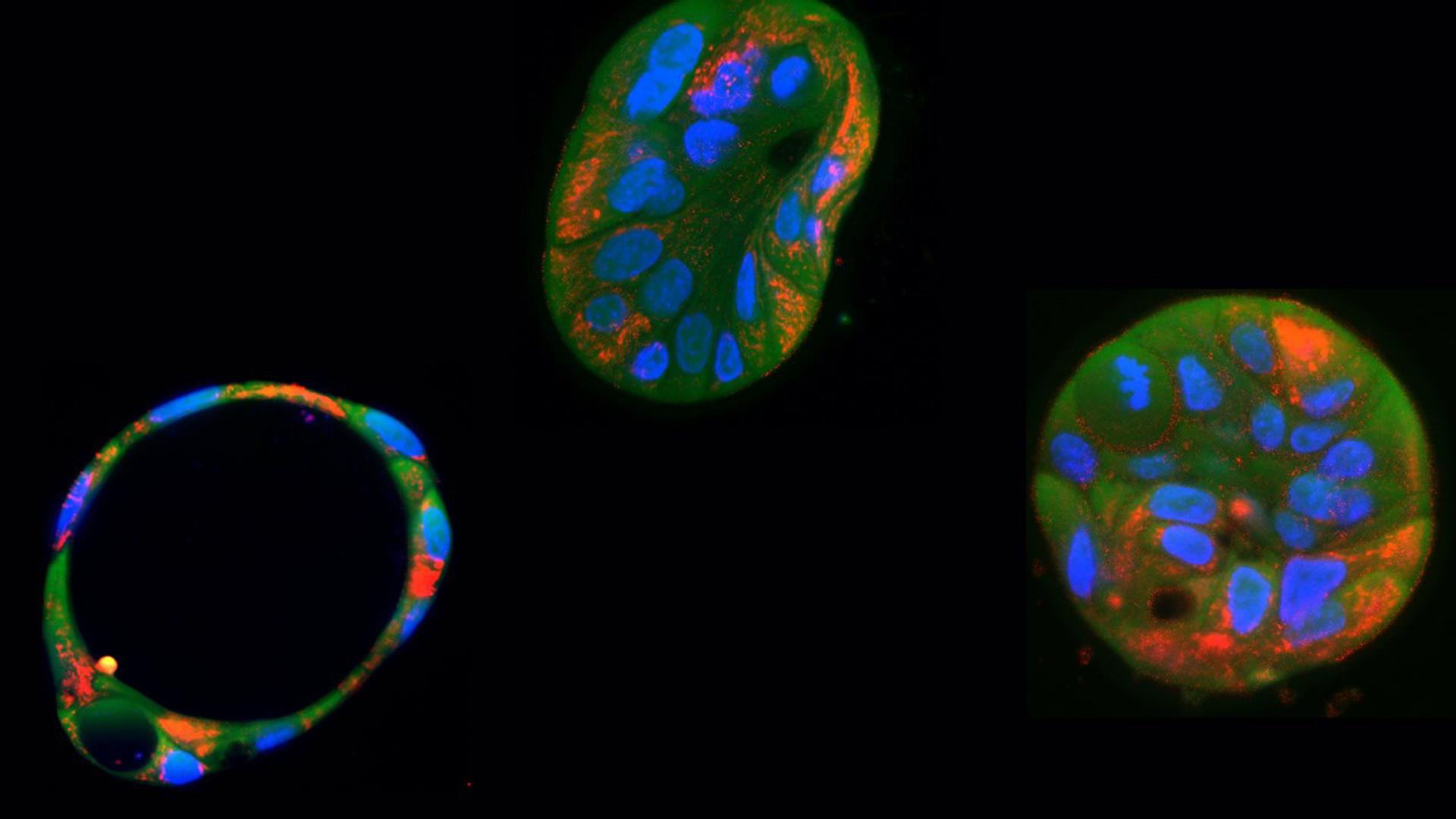
Utilizando organoides hepáticos humanos para generar un modelo de enfermedad mitocondrial, los científicos demostraron que se podían reparar las mutaciones del ADN mitocondrial en múltiples tipos de células relacionadas con enfermedades en el laboratorio.
Para ello, con los editores de bases DdCBE introdujeron una mutación específica en el ADN mitocondrial de células de un organoide de hígado y, después, extrajeron células cutáneas de un paciente con el síndrome de Gitelman -una grave enfermedad congénita mitocondrial- y usaron los editores de bases DdCBE para corregir la mutación y devolver la funcionalidad a las mitocondrias.
Para ayudar a que la terapia avance hacia su uso clínico, los investigadores también probaron la eficacia de administrar los editores de bases mitocondriales en forma de ARNm, en lugar de ADN, y dentro de nanopartículas lipídicas para su administración.
Ambos experimentos demostraron ser más eficaces y menos tóxicos para las células que los métodos más antiguos.
No obstante, el estudio subraya que las ediciones fueron «muy específicas, con cambios mínimos fuera del objetivo detectados en el ADN nuclear y múltiples detectados en el ADN mitocondrial».
«El potencial de la edición de bases mitocondriales en la modelización de enfermedades y las posibles intervenciones terapéuticas la convierte en una vía prometedora para la investigación y el desarrollo futuros en medicina mitocondrial», concluyen los autores.
En declaraciones a la plataforma de divulgación científica SMC España, el investigador en el CNB-CSIC y el CIBERER-ISCIII, Lluís Montoliu, quien no ha participado en el estudio, ha asegurado que este trabajo es «ciertamente relevante», pues «abre las puertas a tratar las gravísimas enfermedades congénitas mitocondriales, hasta ahora incurables, mediante el uso combinado de diversas tecnologías de última generación”.
Por su parte, Santiago Restrepo Castillo, investigador posdoctoral en la Universidad de Texas en Austin (EEUU), quien tampoco ha participado en el estudio, ha dicho al SMC España que el trabajo es «una prometedora prueba de concepto que será complementada por nuevos avances y aplicaciones de editores de ADN mitocondrial en nanopartículas lipídicas, particularmente para el desarrollo de terapias genéticas personalizadas utilizando organoides derivados de pacientes con diferentes mutaciones mitocondriales».