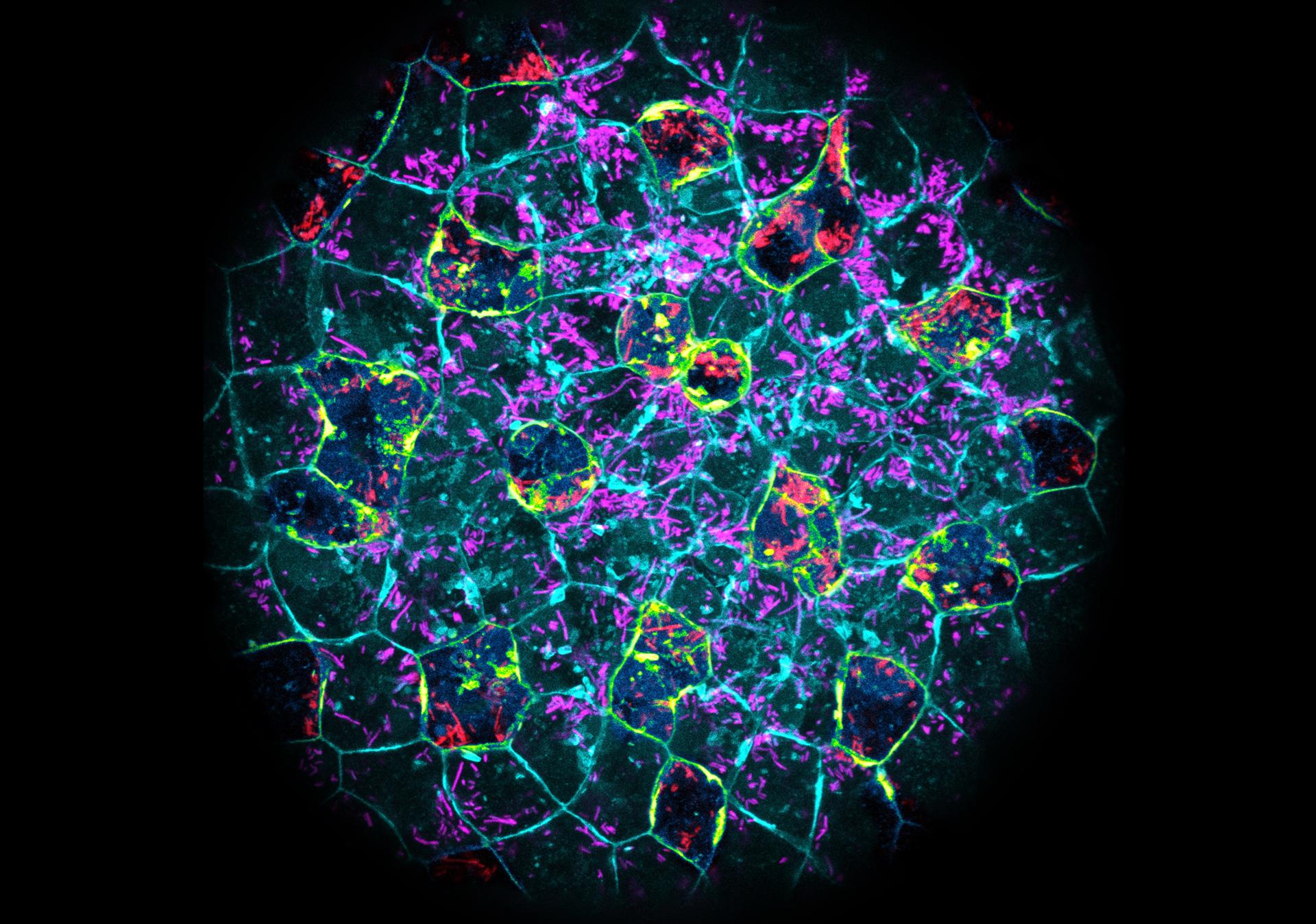
Madrid, 19 jun (EFE).- Embriones de pez cebra usan las células epiteliales de su superficie para destruir las bacterias que pueden causar infecciones, un mecanismo que también está presente en embriones humanos, según un estudio que publica Cell Host and Microbe.
El equipo liderado por investigadores catalanes logró filmar cómo un embrión de pez de pocos días se defendía de una potencial infección por bacterias, usando las células epiteliales, para ingerir y destruir las bacterias mediante un proceso llamado fagocitosis, similar al que realizan los glóbulos blancos.
Esta capacidad de eliminar bacterias también está presente en embriones humanos, señala el estudio, liderado por el Instituto de Biología Molecular de Barcelona (IBMB) del CSIC y del Instituto de Investigación Biomédica de Bellvitge (IDIBELL).
La investigación muestra, con técnicas de microscopía de última generación, cómo las células capturan bacterias como Escherichia coli y Staphylococcus aureus mediante pequeñas protuberancias de su membrana.
Al inicio del desarrollo, antes de la implantación en el útero y de la formación de órganos, los embriones ya cuentan con una forma de defensa que les permite eliminar infecciones bacterianas.
Se trata de un sistema que «podría representar el origen de la inmunidad», destaca Esteban Hoijman, del IBMB y líder de la investigación, en un comunicado del CSIC.
Ese proceso funciona como un mecanismo de fagocitosis. Activa genes de inmunidad en esas células, elimina las bacterias de forma eficaz y contribuye al correcto desarrollo embrionario en caso de infección. Se trata de la primera interacción entre el nuevo organismo en formación y su microentorno biológico
Al inicio del desarrollo, los embriones están expuestos a múltiples cambios en su entorno que pueden representar una amenaza, ya que aún no han desarrollado el sistema inmune que los protege.
Hasta ahora, se desconocía cómo reacciona un embrión ante una bacteria y la investigación revela que las capacidades inmunes comienzan mucho antes de la existencia de los glóbulos blancos.
Hoijman considera que podría ayudar «en el futuro a mejorar la fertilidad, prevenir malformaciones embrionarias y desarrollar nuevas terapias reproductivas”.
El hallazgo también replantea la necesidad de conocer con más detalle la población de bacterias que pueden colonizar el útero, diferenciando las invasoras (y posibles patógenas) de otras potenciales residentes que podrían tener efectos beneficiosos para la fisiología reproductiva, agrega la nota.
La investigación ha contado con la participación de investigadores del Centro de Regulación Genómica (CRG) de Barcelona; de la Universidad Pompeu Fabra (UPF); del Instituto de Bioingeniería de Cataluña (IBEC); de la Universidad de Barcelona (UB); del Hospital Universitario Dexeus y de ICREA.